| Volltext anzeigen | |
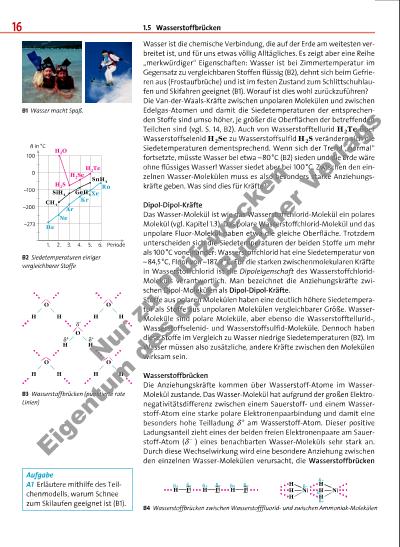
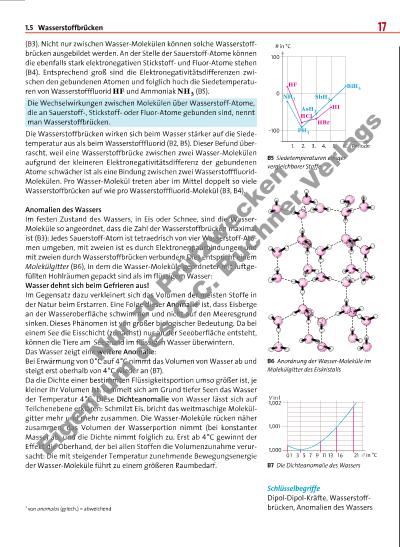
1.5 Wasserstoffbrücken 17 (B3). Nicht nur zwischen Wasser-Molekülen können solche Wasserstoffbrücken ausgebildet werden. An der Stelle der Sauerstoff-Atome können die ebenfalls stark elektronegativen Stickstoffund Fluor-Atome stehen (B4). Entsprechend groß sind die Elektronegativitäts differenzen zwischen den gebundenen Atomen und folglich hoch die Siedetemperaturen von Wasserstofffluorid HF und Ammoniak NH3 (B5). Die Wechselwirkungen zwischen Molekülen über Wasserstoff-Atome, die an Sauerstoff-, Stickstoffoder Fluor-Atome gebunden sind, nennt man Wasserstoffbrücken. Die Wasserstoffbrücken wirken sich beim Wasser stärker auf die Siedetemperatur aus als beim Wasserstofffluorid (B2, B5). Dieser Befund überrascht, weil eine Wasserstoffbrücke zwischen zwei Wasser-Molekülen aufgrund der kleineren Elektronegativitätsdifferenz der gebundenen Atome schwächer ist als eine Bindung zwischen zwei WasserstofffluoridMolekülen. Pro Wasser-Molekül treten aber im Mittel doppelt so viele Wasserstoffbrücken auf wie pro Wasserstofffluorid-Molekül (B3, B4). Anomalien des Wassers Im festen Zustand des Wassers, in Eis oder Schnee, sind die WasserMoleküle so angeordnet, dass die Zahl der Wasserstoffbrücken maximal ist (B3): Jedes Sauerstoff-Atom ist tetraedrisch von vier Wasserstoff-Atomen umgeben, mit zweien ist es durch Elektronenpaarbindungen und mit zweien durch Wasserstoffbrücken verbunden. Dies entspricht einem Molekülgitter (B6), in dem die Wasser-Moleküle geordneter mit luftgefüllten Hohlräumen gepackt sind als im flüssigem Wasser: Wasser dehnt sich beim Gefrieren aus! Im Gegensatz dazu verkleinert sich das Volumen der meisten Stoffe in der Natur beim Erstarren. Eine Folge dieser Anomalie1 ist, dass Eisberge an der Wasseroberfläche schwimmen und nicht auf den Meeresgrund sinken. Dieses Phänomen ist von großer biologischer Bedeutung. Da bei einem See die Eisschicht (zunächst) nur an der Seeoberfläche entsteht, können die Tiere am Seegrund im flüssigen Wasser überwintern. Das Wasser zeigt eine weitere Anomalie: Bei Erwärmung von 0°C auf 4°C nimmt das Volumen von Wasser ab und steigt erst oberhalb von 4°C wieder an (B7). Da die Dichte einer bestimmten Flüssigkeitsportion umso größer ist, je kleiner ihr Volumen ist, sammelt sich am Grund tiefer Seen das Wasser der Temperatur 4 °C. Diese Dichteanomalie von Wasser lässt sich auf Teilchenebene erklären: Schmilzt Eis, bricht das weitmaschige Molekülgitter mehr und mehr zusammen. Die Wasser-Moleküle rücken näher zusammen, das Volumen der Wasserportion nimmt (bei konstanter Masse) ab, und die Dichte nimmt folglich zu. Erst ab 4 °C gewinnt der Effekt die Oberhand, der bei allen Stoffen die Volumenzunahme verursacht: Die mit steigender Temperatur zunehmende Bewegungsenergie der Wasser-Moleküle führt zu einem größeren Raumbedarf. B5 Siedetemperaturen einiger vergleichbarer Stoffe B6 Anordnung der Wasser-Moleküle im Molekülgitter des Eiskristalls B7 Die Dichteanomalie des Wassers Schlüsselbegriffe Dipol-Dipol-Kräfte, Wasserstoffbrücken, Anomalien des Wassers1 von anomalos (griech.) = abweichend 100 0 –100 1. 2. 3. 4. 5. 6. Periode HI SbH3 HBr HCl HF BiH3 NH3 PH3 AsH3 in °C 1,000 1 V in l 3 5 7 9 11 13 16 21 1,001 1,002 0 in °C N r z P rü fz w e c k e n E ig e n tu m d e s C .C . B u c h n e r V e rl a g s | |
 « |  » |
|
» Zur Flash-Version des Livebooks | |