| Volltext anzeigen | |
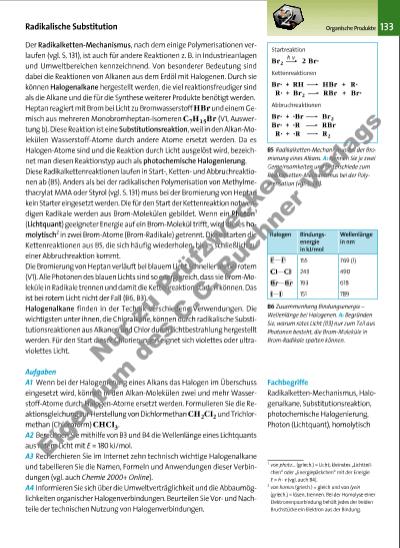
133Organische Produkte B5 Radikalketten-Mechanismus bei der Bromierung eines Alkans. A: Nennen Sie je zwei Gemeinsamkeiten und Unterschiede zum Radikalketten-Mechanismus bei der Polymerisation (vgl. S. 131). B6 Zusammenhang Bindungsenergie – Wellenlänge bei Halogenen. A: Begründen Sie, warum rotes Licht (B3) nur zum Teil aus Photonen besteht, die Brom-Moleküle in Brom-Radikale spalten können. Der Radikalketten-Mechanismus, nach dem einige Polymerisationen verlaufen (vgl. S. 131), ist auch für andere Reaktionen z. B. in Industrieanlagen und Umweltbereichen kennzeichnend. Von besonderer Bedeutung sind dabei die Reaktionen von Alkanen aus dem Erdöl mit Halogenen. Durch sie können Halogenalkane hergestellt werden, die viel reaktionsfreudiger sind als die Alkane und die für die Synthese weiterer Produkte benötigt werden. Heptan reagiert mit Brom bei Licht zu Bromwasserstoff HBr und einem Gemisch aus mehreren Monobromheptan-Isomeren C7H15Br (V1, Auswertung b). Diese Reaktion ist eine Substitutionsreaktion, weil in den Alkan-Molekülen Wasserstoff-Atome durch andere Atome ersetzt werden. Da es Halogen-Atome sind und die Reaktion durch Licht ausgelöst wird, bezeichnet man diesen Reaktionstyp auch als photochemische Halogenierung. Diese Radikalkettenreaktionen laufen in Start-, Kettenund Abbruchreaktionen ab (B5). Anders als bei der radikalischen Polymerisation von Methylmethacrylat MMA oder Styrol (vgl. S. 131) muss bei der Bromierung von Heptan kein Starter eingesetzt werden. Die für den Start der Kettenreaktion notwendigen Radikale werden aus Brom-Molekülen gebildet. Wenn ein Photon1 (Lichtquant) geeigneter Energie auf ein Brom-Molekül trifft, wird dieses homolytisch2 in zwei Brom-Atome (Brom-Radikale) getrennt. Diese starten die Kettenreaktionen aus B5, die sich häufig wiederholen, bis es schließlich zu einer Abbruchreaktion kommt. Die Bromierung von Heptan verläuft bei blauem Licht schneller als bei rotem (V1). Alle Photonen des blauen Lichts sind so energiereich, dass sie Brom-Moleküle in Radikale trennen und damit die Kettenreaktion starten können. Das ist bei rotem Licht nicht der Fall (B6, B3). Halogenalkane finden in der Technik verschiedene Verwendungen. Die wichtigsten unter ihnen, die Chloralkane, können durch radikalische Substitutionsreaktionen aus Alkanen und Chlor durch Lichtbestrahlung hergestellt werden. Für den Start dieser Chlorierungen eignet sich violettes oder ultraviolettes Licht. Aufgaben A1 Wenn bei der Halogenierung eines Alkans das Halogen im Überschuss eingesetzt wird, können in den Alkan-Molekülen zwei und mehr Wasserstoff-Atome durch Halogen-Atome ersetzt werden. Formulieren Sie die Reaktionsgleichung zur Herstellung von Dichlormethan CH2Cl2 und Trichlormethan (Chloroform) CHCl3. A2 Berechnen Sie mithilfe von B3 und B4 die Wellenlänge eines Lichtquants aus rotem Licht mit E = 180 kJ/mol. A3 Recherchieren Sie im Internet zehn technisch wichtige Halogenalkane und tabellieren Sie die Namen, Formeln und Anwendungen dieser Verbindungen (vgl. auch Chemie 2000+ Online). A4 Informieren Sie sich über die Umweltverträglichkeit und die Abbaumöglichkeiten organischer Halogenverbindungen. Beurteilen Sie Vorund Nachteile der technischen Nutzung von Halogenverbindungen. Radikalische Substitution Fachbegriffe Radikalketten-Mechanismus, Halogenalkane, Substitutionsreaktion, photochemische Halogenierung, Photon (Lichtquant), homolytisch 1 von photo… (griech.) = Licht; kleinstes „Lichtteilchen“ oder „Energiepäckchen“ mit der Energie E = h · n (vgl. auch B4). 2 von homos (griech.) = gleich und von lyein (griech.) = lösen, trennen. Bei der Homolyse einer Elektronenpaarbindung behält jedes der beiden Bruchstücke ein Elektron aus der Bindung. Startreaktion Br2 2 Br· Kettenreaktionen Br· + RH HBr + R· R· + Br2 RBr + Br· Abbruchreaktionen Br· + ·Br Br2 Br· + ·R RBr R· + ·R R2 h n Halogen Bindungsenergie in kJ/mol 155 243 193 151 Wellenlänge in nm 769 (!) 490 618 789 Cl Cl F F Br Br I I 3377_01_01_2012_Kap3_124_211 23.09.14 06:28 Seite 133 Nu r z u Pr üf zw ec ke n Ei ge nt um d es C .C . uc hn er V e la gs | |
 « |  » |
|
» Zur Flash-Version des Livebooks | |