| Volltext anzeigen | |
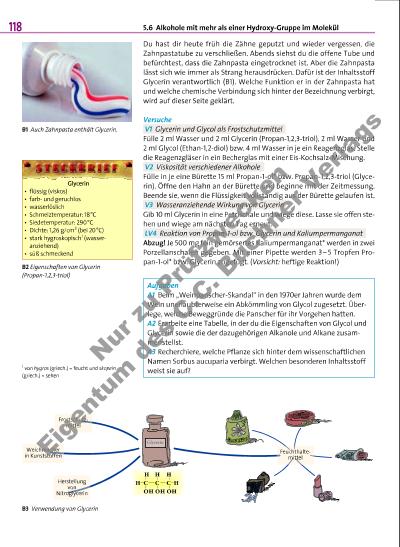
5.6 Alkohole mit mehr als einer Hydroxy-Gruppe im Molekül 119 Alkanole sind einwertige, gesättigte Alkohole, da im Molekül nur eine Hydroxy-Gruppe vorhanden ist und Mehrfachbindungen zwischen Kohlenstoff-Atomen fehlen. Sind an einen gesättigten Alkyl-Rest mehrere Hydroxy-Gruppen gebunden, liegt ein mehrwertiger Alkohol vor. Der systematische Namen für einen mehrwertigen Alkohol ergibt sich aus dem des zugrundeliegenden Alkans, dem griechischen Zahlwort für die Anzahl der Hydroxy-Gruppen und der Endung -ol. Typische Beispiele für mehrwertige Alkohole sind Ethan-1,2-diol (ein zweiwertiger Alkohol; B4) und Propan-1,2,3-triol (ein dreiwertiger Alkohol; B3). Die Ziffern vor dem griechischen Zahlwort beziehen sich auf die Kohlenstoff-Atome, an denen die Hydroxy-Gruppen gebunden sind. Ethan-1,2-diol (Glycol) und Propan-1,2,3-triol (Glycerin) Ethan-1,2-diol ist eine farblose, ölige Flüssigkeit. Der Trivialname Glycol2 weist auf eine wichtige Eigenschaft hin: den süßen Geschmack. Glycol setzt die Gefriertemperatur von Wasser herab (V1). Es dient deshalb als Frostschutzmittel, z.B. in wassergekühlten Motoren, und wird in großen Mengen zum Enteisen von Flugzeugen verwendet (B5). Propan-1,2,3-triol (Glycerin) ist eine viskose Flüssigkeit (V2). Wie V3 zeigt, nimmt die Masse zu, wenn Glycerin längere Zeit offen an der Luft steht. Glycerin nimmt Wasser in Form von Wasserdampf aus der Umgebung auf. Man sagt, Glycerin ist wasseranziehend (hygroskopisch). Deshalb wird es in vielen Produkten als Feuchthaltemittel verwendet (B3). Entdeckt wurde Glycerin bereits im Jahr 1779 durch den deutschen Chemiker Carl Wilhelm Scheele, als er Olivenöl zersetzte. Heute weiß man, dass das Glycerin-Molekül ein Baustein aller Fett-Moleküle (vgl. S. 145) ist. Glycol und Glycerin schmecken süß, sind viskoser und haben höhere Schmelzund Siedetemperaturen als die entsprechenden Alkanole. Diese Unterschiede in den Eigenschaften sind darauf zurückzuführen, dass die Moleküle eines mehrwertigen Alkohols (mit zunehmender Anzahl an Hydroxy-Gruppen) mehr Wasserstoffbrücken bilden als die Moleküle der jeweiligen Alkanole. Auch chemische Eigenschaften wie die reduzierende Wirkung (LV4) werden stärker. Sorbit – auch ein mehrwertiger Alkohol Sorbitol (Sorbit) ist ein sechswertiger Alkohol. An jedes der 6 KohlenstoffAtome ist eine Hydroxy-Gruppe gebunden (B6). Wichtige Eigenschaften von Sorbit, die aus dieser Molekülstruktur folgen, sind u. a. der süße Geschmack und die sehr gute Wasserlöslichkeit. Man verwendet Sorbit anstelle von Zucker zum Süßen von Produkten. Das Lösen von Sorbit ist ein verhältnismäßig stark endothermer Vorgang (+110,8 kJ/kg; zum Vergleich: Saccharose + 18,1 kJ/kg). Der Energiebetrag wird während des Lösevorgangs der Bewegungsenergie der Wasser-Moleküle entzogen. Die Temperatur der Lösung sinkt („Lösungskälte“). Deshalb nimmt man beim Auflösen von sorbithaltigen Produkten im Mund einen kühlenden Effekt wahr. Diesen Effekt nutzt man z.B. bei Produkten mit Pfefferminzgeschmack. H O HC H O HC H H B4 Strukturformel eines Ethan-1,2-diolMoleküls B5 Unentbehrlich ist Glycol beim Enteisen der Flugzeuge im winterlichen Flugverkehr. Schlüsselbegriffe mehrwertiger Alkohol, Glycol, Glycerin, Sorbit H O HC HC C H O HC H O HC C O H O H H H O H H H B6 Strukturformel eines Sorbit-Moleküls 2 von glycos (griech.) = süß N u r zu P rü fz w e c k e n E ig e n t m d e s C .C . B u c h n e r V e rl a g s | |
 « |  » |
|
» Zur Flash-Version des Livebooks | |